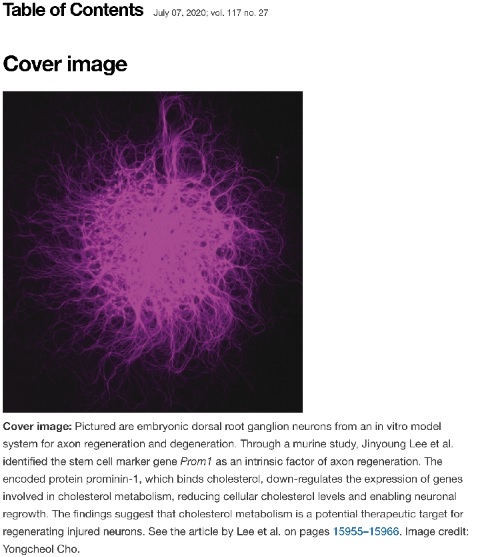
조용철 교수(생명과학부), 신경 재생의 새로운 제어 인자와 원리 규명
신경계(nervous system)는 생명 조건을 유지하기 위한 필수적인 학습/감각인지/운동 능력 제어 등을 관장하고 있으며, 이러한 기능은 생명이 다하는 순간까지 온전하게 유지 되어야 합니다. 그런데, 신경세포(neuron)에서 뻗어 나오는 축삭(axon)은 구조적으로 손상에 매우 취약하여, 물리적인 스트레스를 받으면 일시적인 기능장애 혹은 신경 기능의 회복이 불가능한 상태에 빠지게 됩니다. 이것은 축삭의 절단(axotomy) 그리고 퇴행(axon degeneration)으로 이어질 수 있으며, 이로 인한 Die-back현상에 의해 신경세포체가 사멸하게 될 수 있으며 이것은 영구적인 신경기능손실을 유발하며 회복 불가능한 장애에 빠지게 됩니다. 이에, 신경 손상 이후 나타나는 생물학적인 반응을 이해하고 재생 과정의 원리를 밝혀, 이를 통해 손상 이전의 정상 기능을 회복할 수 있도록 치료 방법을 개발하는 것이 중요합니다.
본 연구는 이러한 과정에서 벌어지는 생물학적 제어 현상을 비교전사체분석(Comparative transcriptomic analysis)을 통해 해석하고 핵심제어인자를 동정하고 이를 응용하여 신경 재생 능력이 증폭될 수 있음을 보여준 연구입니다. 고려대학교 조용철 교수(생명과학부)와 고려대학교 신경재생 및 퇴행 연구팀(제1저자 이진영 박사과정생, 신정은 연구교수)은 줄기세포 표지자로 많이 알려진 Prom1 유전자가 Smad 신호전달을 통해 감각신경세포의 콜레스테롤 생합성을 저해함으로써 신경 재생을 촉진한다고 밝혔습니다.
손상 이후, 신경세포에서 내재적으로 재생을 조절하는 전사체를 연구하는 기존의 방식과 달리 재생 프로그램을 조절할 수 있는 줄기세포 표지자인 유전자를 처음 찾음으로써 기존 연구방식에서 탐색하지 못한 새로운 연구의 영역을 넓혔습니다. 신경세포 내재적 재생 조절 프로그램은 생명의 발생 단계 및 성장 그리고 노화 등 주기의 단계에 따라 유동적으로 변하는 영향을 받아, 그 효과가 변하게 되는데, 특히 Prom1 유전자는 개체 발생단계가 진행됨에 따라 감각신경에서 그 발현의 양이 감소하는 것을 밝혔고, 아데노바이러스(Adeno-associated virus, AAV)를 이용해 나이가 든 성체 생쥐에 다시 발현을 증가시키면 신경세포의 축삭 재생 능력을 향상시킨다는 것을 증명하였습니다. 이 과정은 최근 주목받고 있는 신경세포의 콜레스테롤 대사 과정의 조절을 통해 이뤄짐을 증명하였습니다. 이 연구결과는 미국국립과학원 (National Academy of Sciences)에서 발행하는 ‘PNAS(Proceedings of the National Academy of Sciences of the United States of America)에 발표되었으며, PNAS 117권 27호 표지로 소개 되었습니다.
본 연구는 한국연구재단의 SRC사업의 지원으로 이루어 졌습니다.

<PNAS 117권 27호 표지 내용>